Reacciones de Indicadores
Indicadores ácido base.
Un Indicador es una sustancia que siendo ácidos o bases
débiles al añadirse a una muestra sobre la que se desea realizar el
análisis, se produce un cambio químico en el que es apreciable,
generalmente, un cambio de color; esto ocurre porque estas sustancias
sin ionizar tienen un color distinto que al ionizarse.
Tambien Puede decirse que son colorantes cuyo color cambia según estén en
contacto con un ácido o con una base. El indicador ácido base dependerá del pH de la misma.
1. El "Viraje" Es la variación de color. Para esto el indicador debe cambiar su estructura química ya sea
al perder o aceptar un protón.
indicador ácido base dependerá del pH de la misma.
Aqui tenemos 3 indicadores de uso común:
Naranja de metilo (viraje ácido)
Azul de bromotimol (viraje neutro)
Fenolftaleína (viraje básico)
Los indicadores más usados son:
Estos son algunos ejemplos de Indicadores Mas Usados:- Indicador de pH, detecta el cambio del pH.
- Indicador redox, un indicador químico de titulación redox.
- Indicador complejométrico, un indicador químico para iones metálicos en complejometría.
- Indicador de precipitación, utilizado para valoraciones de precipitación o solubilidad, generalmente gravimetrias...
Esta tabla representa alguos de los Indicadores (Àcido Base) que pueden presentarse en la Quimica...
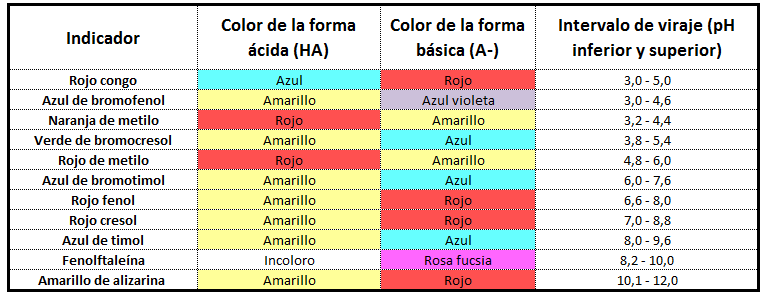
 |
| Tabla de Acidos |
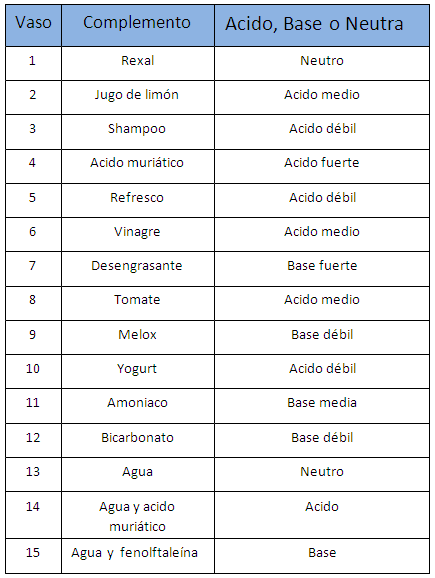 |
| Tabla de Acido-Base |
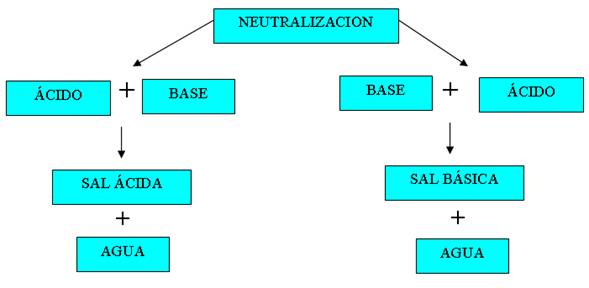
Reacciones de Neutralizacion
Son las reacciones
entre un ácido y una base, con el fin de determinar la concentración de
las distintas sustancias en la disolución.
Tienen lugar cuando un ácido reacciona totalmente con una base, produciendo sal y agua. Sólo hay un único caso donde no se forma agua en la reacción, se trata de la combinación de óxido de un no metal, con un óxido de un metal.
Tienen lugar cuando un ácido reacciona totalmente con una base, produciendo sal y agua. Sólo hay un único caso donde no se forma agua en la reacción, se trata de la combinación de óxido de un no metal, con un óxido de un metal.
Un ejemplo seria:
Ácido + base → sal + agua
Por ejemplo: HCl + NaOH → NaCl + H2O